Bu yörüngelerde elektronlar bulunur. Yörünge numarasına Baş kuantum sayısı da denir ve n ile gösterilir. Benzer Elektronların orbitalleri nasıl doldurduğunu öğrenirken aklımızda tutmamız gereken iki önemli kural bulunuyor: Her orbitalde sadece iki elektron bulunabiliyor. Elektronlar en düşük enerji seviyesinden başlayıp, daha yüksek seviyelere gidecek şekilde orbitalleri dolduruyor.
Atomların Enerji Düzeyleri Hidrojen elementinin gaz fazındaki spektrumlarının incelenmesi atom modellerinin gelişmesine önemli katkıda bulunmuştur. Atomların belli frekanslarda elektromagnetik ışıma yapması,atomun sahip olacağı enerji değerlerinin kesikli olduğunu gösterir.
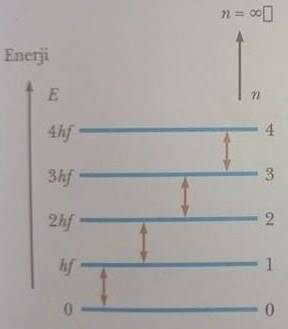
Atomun sahip olabileceği bu iç. Uyarılmış hidrojen atomlarında elektron yüksek enerji seviyesindeki yörüngeden, düşük enerji seviyesindeki yörüngeye geçişinde yaptıkları ışımalara sprektrum. Bir atomun enerjisi rasgele bir değerde olamaz, yani kesiklidir. Enerji düzeylerini gösteren diyagram, her atomun sahip olabileceği enerji seviyelerini göstermek için kullanılır.
Gönderilen fotonun enerjisini ayarlamak için sürgünün üzerini tıklayınız ve sürükleyiniz. Aşağıdaki deney düzeneğinde, içi Hidrojen gazı dolu olan kaptaki küçük cam delikten beyaz ışık gönderilmiştir. Enerji seviyesini değiştirmek için elektronu sürükleyiniz.
Gönderilen bu ışın gaz molekülleriyle etkileşerek karşısındaki delikten çıkmıştır. Birde, ışığın gazla etkileşiminin sonucunda, gaz atomları da ışıma yapmış ve kaptaki üçüncü bir delikten dışarıya ışık yayılmıştır.

Matematikten sanat tarihine, ekonomiden fen bilimlerine. Calculating electron energy for levels n=to 3. Drawing a shell model diagram and an energy diagram for. Elektronların atomda çekirdek etrafında nasıl dizildiğini ve bunu belirleyen kuralları anlamak için atomdaki enerji düzeylerini ve bunları belirlemek için kullanılan kuantum sayılarını bilmek gerekir. Scrödinger denkleminin çözümüne göre bu kuantum sayıları baş kuantum sayısı n, yan kuantum sayısı l ve magnetik kuantum . Elektronlar belli enerjilere sahiptirler ve elektronların yörüngeleri çekirdekten belirli uzaklıklarda bulunabilirler.
Bu düşünce Franck-Hertz deneyi ile doğrulanmıştır. Elektron alış verişi yapmamış (nötr) bir atomda proton sayıları elektron sayılarına eşittir, bu nedenle tabloda elektron sayıları proton sayılarına eşittir. Atom numarası, enerji seviyeleri ve elektronların enerji seviyelerini doldurması arasındaki ilişki standart periyodik . Atomda çeşitli tabakalar bulunduğu gibi,her tabakada da çeşitli alt enerji düzeyleri veya orbitaller bulunur. Enerji düzeyleri belli sayıda elektron içerir ve elektronların bu enerji düzeylerinde ne şekilde dizildiklerini ilgili kuantum sayıları belirli kurallar çerçevesinde tayin. Burada, çok elektronlu atomlar bölümü sadece bir düşünce tarzından yola çıkılarak üretilmiştir ve mantık yürüterek yaklaşık sonuçlar bulunmuştur.
Hidrojen atomlarını içeren bir ortam, uygun bir kaynakla uyarıldığında yayılan ışık önce bir yarıklı levhadan geçirildi. Aslında elektronlar dolanırken enerji düzeylerini korurlar, yani ışınım biçiminde enerji kaybetmezler. Bohr teorisi, tek elektronlu sistemlerde enerji düzeyleri arası geçişler. Balmer, Rydberg eşitliği. Kolay olsundiye, belirli bir elementin yalnız bir tek çizgi verdiğini,yani, kesinlikle belirli bir enerjisi olan fotonlar saldığını düşününüz.
Atom, fotonsalınmasından önce enerji bakımından daha varsıl, sonraise daha yoksuldur.